Livets opprinnelse: -intracellulær signalering og kalsiumgradient
 Hvordan intracellulær kalsiumsignalering, gradient og dens rolle som en universell intracellulær regulator peker på design
Hvordan intracellulær kalsiumsignalering, gradient og dens rolle som en universell intracellulær regulator peker på design
Oversatt herfra.
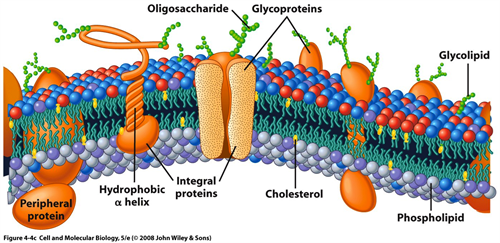
Bilde 1. Membran med permeable porter
I lys av viktigheten av kalsium (Ca2+) som en universell intracellulær regulator, dens essensielle rolle i cellesignalering og kommunikasjon i mange biologiske intra- og ekstracellulære prosesser, er det overraskende hvor lite den er nevnt i debatten om opprinnelse (evolusjon/ID). De fleste diskusjoner om livets opprinnelse starter med RNA-verdener versus metabolisme første scenarier, panspermi, hydrotermisk sjakt- teori etc. Livets opprinnelse kan ikke belyses uten å ta hensyn til og forklare hvordan kalsium-signaleringsmaskineriet og cellehomeostasen dukket opp.
Kalsiumgradienten:
 Cellenes evne til å opprettholde en stor gradient av kalsium over deres ytre membran er universell. Alle biologiske celler har lav cytosolisk (væske som finnes inne i celler) kalsiumkonsentrasjon, kan og må beholde denne selv når det frie kalsiumet utenfor er opptil 20 000 ganger høyere konsentrert! De første livsformene krevde et effektivt Ca2+ homeostatisk system, som opprettholdt intracellulær Ca2+ i behagelig lave konsentrasjoner - et sted rundt 100 nanomolar, dette er ~10 000-20 000 ganger lavere enn det i det ekstracellulære miljøet. Bekadigelse av plasmamembranens evne til å opprettholde denne gradienten, vil få kalsium til å strømme inn i cellen, utfelle kalsiumfosfat, skade det ATP-genererende maskineriet og drepe cellen. Ved millimolare konsentrasjoner konkurrerer kalsium med Mg2+ (magnesium), binder seg til DNA og RNA og hemmer det.
Cellenes evne til å opprettholde en stor gradient av kalsium over deres ytre membran er universell. Alle biologiske celler har lav cytosolisk (væske som finnes inne i celler) kalsiumkonsentrasjon, kan og må beholde denne selv når det frie kalsiumet utenfor er opptil 20 000 ganger høyere konsentrert! De første livsformene krevde et effektivt Ca2+ homeostatisk system, som opprettholdt intracellulær Ca2+ i behagelig lave konsentrasjoner - et sted rundt 100 nanomolar, dette er ~10 000-20 000 ganger lavere enn det i det ekstracellulære miljøet. Bekadigelse av plasmamembranens evne til å opprettholde denne gradienten, vil få kalsium til å strømme inn i cellen, utfelle kalsiumfosfat, skade det ATP-genererende maskineriet og drepe cellen. Ved millimolare konsentrasjoner konkurrerer kalsium med Mg2+ (magnesium), binder seg til DNA og RNA og hemmer det.
Bilde 2. Signallering avhengig av kalsium-gradient
Ca2+ binder seg til nukleotider, så de ikke fungerer som de skal. Og avgjørende: Ca2+, ved for høye konsentrasjoner, utfeller karbonat, fosfat og sulfat. Så hvis en urcelle skulle fungere, måtte den kvitte seg med Ca2+, og senke den i det minste til submillimolære nivåer, om ikke submikromolære. Faktisk, uten kontroll av intracellulær Ca2+, ville livet aldri kommet i gang! Kontroll av intracellulær Ca2+ måtte være et avgjørende skritt for å la de originale cellene overleve og replikere, selv før RNA- eller DNA-syntese kunne begynne for alvor. Bevisene vi har fra molekylærbiologi, sammen med den toksiske naturen til langvarige høye Ca2+-nivåer inne i cellene, argumenterer sterkt for at urceller må ha hatt Ca2+-pumper for å holde sitt frie intracellulære Ca2+ lavt, og sette scenen for 'kalsiumtrykket' på tvers av den tidens plasmamembran som skal utnyttes til å fungere som kilde for celleaktivering.
For å opprettholde en så lav cytosolisk kalsiumkonsentrasjon, må Ca2+-ioner dermed transporteres mot en bratt konsentrasjonsgradient. I tillegg blir de positivt ladede molekylene ofte transportert mot et svært negativt membranpotensial, noe som bidrar til en stor elektrokjemisk gradient for Ca2+-ioner. Konsentrasjonen er tett regulert av Ca 2+ -bindende proteiner, Ca 2+ pumper og andre transportører. Denne gradienten må opprettholdes ved kontinuerlig ekskludering av Ca2+ fra cellen. Fjerning av Ca2+ ved aktiv ekstrudering krever energi for å pumpe Ca2+ mot den elektrokjemiske gradienten. Det metabolske apparatet som tjener denne  funksjonen involverer Ca2+ proteinbaserte og ikke-proteinholdige kanaler, Ca2+ antiportere (Ca2+/2H+, Ca2+/Na+) og ATP-avhengige Ca2+ pumper.
funksjonen involverer Ca2+ proteinbaserte og ikke-proteinholdige kanaler, Ca2+ antiportere (Ca2+/2H+, Ca2+/Na+) og ATP-avhengige Ca2+ pumper.
Bilde 3. Manglende elektron-gradient stopper produksjon
Å lage en kraftgradient (som er en termodynamisk oppoverbakke) er alltid en ingeniørprestasjon, og mye kunnskap, planlegging og intelligens kreves for oppsett. Hydroelektriske dammer er svært komplekse, og er alltid et resultat av mange års planlegging av de mest dyktige, utdannede og kunnskapsingeniørene i store selskaper. Når det gjelder mange menneskelige oppfinnelser, er ingeniørløsningene som mennesket har oppdaget, brukt i naturen i det minste siden livet begynte på en langt mer forseggjort og sofistikert måte. Så livløs kjemi hadde den medfødte drivkraften til forsøk og feil for å produsere en cellemembran, og blant tonnevis av andre ting, en Ca+ gradient gjennom svært komplekse kalsiumkanaler for å holde en 10 000 ganger høyere konsentrasjon av kalsium utenfor cellen enn inne i cytosolen for å skape et miljø som er egnet for en protocelle for å beholde sine vitale funksjoner og ikke dø ? Hvorfor skulle kjemiske elementer gjøre det? Hadde de den medfødte drivkraften og målet å bli levende og beholde en stemningsforutsetning, homeostase av ulike elementer, for å tillate liv?
Kalsiumsignalering:
Metabolisme av ATP krevde at intracellulært fritt Ca(2+) ble satt til ekstremt lave konsentrasjoner, noe som igjen ga bakgrunnen for rollen til Ca(2+) som et universelt signalmolekyl. Videre er Ca(2+) en universell bærer av biologisk informasjon, og en av de mest brukte signaltransduksjons-mekanismene: Den kontrollerer cellelivet fra dets opprinnelse ved befruktning, til slutten i prosessen med programmert celledød. Ca(2+) er en konvensjonell diffuserbar budbærer som frigjøres inne i celler ved interaksjon av første budbringere med plasmamembran-reseptorer. Den kanskje mest karakteristiske egenskapen til Ca(2+)-signalet er dets ambivalens: selv om det er essensielt for riktig funksjon av celler, blir Ca(2+) et middel som medierer cellenød, eller til og med (giftig) celledød, hvis konsentrasjonen er og bevegelser inne i cellene ikke er nøye innstilt. Et langvarig høyt nivå av intracellulært fritt Ca2+ skader irreversibelt mitokondrier og kan forårsake kromatinkondensasjon, utfelling av fosfat og protein og aktivering av nedbrytende enzymer som proteaser, nukleaser og fosfolipaser.
Kalsiumioner (Ca2+) fungerer som et universelt signal for å modulere nesten alle aspekter av cellulær funksjon i alle celler. Celler i livets tre domener har alle en rekke universaliteter, inkludert intracellulær Ca2+. Kalsium bærer meldinger til praktisk talt alle viktige funksjoner til cellene. Ca2+-signalveien spiller en sentral budbringerrolle i å regulere mange cellulære prosesser, inkludert befruktning, sammentrekning, eksocytose, transkripsjon, apoptose og læring og hukommelse. Ca 2+ kontrollerer de viktigste cellefunksjonene i alle eukaryote organismer. Befruktning, muskelkontraksjon, sekresjon, flere faser av metabolisme, gentranskripsjon, apoptotisk død, etc. er fint orkestrert av den funksjonelle allsidigheten til Ca 2+-signalering og dens utsøkte romlige og tidsmessige regulering. Mest sannsynlig har dens unike koordinasjonskjemi vært en avgjørende faktor da den gjør bindingen av komplekse molekyler spesielt lett, selv i nærvær av store overskudd av andre kationer, f.eks. magnesium. Dens frie konsentrasjon i cellene kan dermed opprettholdes på de svært lave nivåene som kreves av signalfunksjonen. En stor ramme av proteiner eksisterer for å binde eller transportere kalsium. De bidrar alle til å bufre den i cellene, men en rekke av dem dekoder også meldingen til fordel for målet. De viktigste av disse "kalsiumsensorene" er EF-håndproteinene.
Bilde 4. Cellens metabolisme
 Gitt den sentrale rollen til intracellulær kalsiumsignalering i den levende verden, er en bedre forståelse av sammensetningen av dette kalsiumsignalerings-verktøysettet, og proteinene som utgjør det, avgjørende for vår globale forståelse av hva som var nødvendig for at celler skulle dukke opp. Disse vitenskapelige studiene fremhever den høye bevaringen av kalsium-verktøysettet fra prokaryoter til metazoer og den økende kompleksiteten til proteinene som utgjør det. Nødvendigheten av å eksportere Ca2+ fra celler er en direkte konsekvens av Ca2+-signalets ambivalente natur. Ca2+ er viktig for cellene: Det styrer opprinnelsen til nytt liv ved befruktning og hjelper cellene når deres vitale syklus har kommet til slutten. Mellom opprinnelse og slutt veileder imidlertid Ca2+ cellene i det meste av det de må gjøre for å oppfylle oppgavene som er tildelt dem. Balansen av Ca2+ mellom celler og omgivelsene utenfor må reguleres med ytterste presisjon: enhver flukt som på en eller annen måte vil endre balansen ved å la intern Ca2+ øke over det optimale nivået, gir undergang for cellene.
Gitt den sentrale rollen til intracellulær kalsiumsignalering i den levende verden, er en bedre forståelse av sammensetningen av dette kalsiumsignalerings-verktøysettet, og proteinene som utgjør det, avgjørende for vår globale forståelse av hva som var nødvendig for at celler skulle dukke opp. Disse vitenskapelige studiene fremhever den høye bevaringen av kalsium-verktøysettet fra prokaryoter til metazoer og den økende kompleksiteten til proteinene som utgjør det. Nødvendigheten av å eksportere Ca2+ fra celler er en direkte konsekvens av Ca2+-signalets ambivalente natur. Ca2+ er viktig for cellene: Det styrer opprinnelsen til nytt liv ved befruktning og hjelper cellene når deres vitale syklus har kommet til slutten. Mellom opprinnelse og slutt veileder imidlertid Ca2+ cellene i det meste av det de må gjøre for å oppfylle oppgavene som er tildelt dem. Balansen av Ca2+ mellom celler og omgivelsene utenfor må reguleres med ytterste presisjon: enhver flukt som på en eller annen måte vil endre balansen ved å la intern Ca2+ øke over det optimale nivået, gir undergang for cellene.
Kontrollert miljø er essensen av livet. Denne cellulære separasjonen fra omgivelsen bygger stort sett rundt et enkelt og effektivt prinsipp om divide et impera, dvs. dele verden inn i ytre miljø og indre rom og styrer alt som går inn eller ut av den levende cellen/organismen. Ca2+ tillater bindingsreaksjoner som er ~100 ganger raskere enn Mg2+(magnesium).
Opprettholdelse av stabiliteten til celler, osmotisk, elektrisk og kjemisk, er livsviktig, og krever at cellen avviser visse elementer som ioner, nemlig Na+ (natrium), Ca2+ (kalsium) og cl (klor), samtidig som den beholder K+ (kalium). ioner) og Mg2+ (magnesium). Nivåene av disse enkle ionene er relatert til cellens aktiviteter, både til metabolisme og til DNA-funksjon. Dette kravet om å avvise Ca2+ i de innledende stadiene av livet er forutsetningen for alle dets avanserte funksjoner. For å opprettholde jevne strømningstilstander har celler mange signalsystemer (kretser) som bruker bærere og budbringere, blant hvilke ko-enzymer er av stor betydning. For å beskrive cellulær homeostase må totalt rundt tjue elementer reguleres.
Å oppnå dette er allerede en stor bragd. Hvordan oppnådde livløs materie dette uten veiledende intelligens?
Uatskillelig tandem: evolusjon velger ATP og Ca2+ for å kontrollere liv, død og cellulær signalering.
Helt fra begynnelsen av biologisk evolusjon ble ATP valgt som et flerbruks energilagrende molekyl. Måtte det ikke etableres tilstrekkelig energitilførsel i cellen før livet begynte? Og så, hadde ikke opprinnelsen til energiforsyningen måtte settes opp uten å ha evolusjon for hånden som drivkraft, siden DNA-replikering ikke var satt opp ennå? Likevel er lav Ca2+-konsentrasjon i cellen en forutsetning for ATP-metabolisme.
Det skaper enda en bemerkelsesverdig catch22-situasjon, siden for en Ca2+-gradient kreves membrankanaler, som kun lages ved å bruke ATP som energikilde for biosyntesen. Men produksjonen av ATP krever en eksisterende kalsiumgradient !! De foreslåtte naturalistiske forklaringene, som Donnan-potensial uten å kreve Ca 2+ -ATPaser og antiporter, er i beste fall fantasifulle.
Bilde 5. ATP-motor prinsipp-skisse
 ATP-effekter formidles av en utvidet familie av purinoseptorer ofte knyttet til Ca(2+)-signalering. I likhet med atmosfærisk oksygen, må Ca(2+) ha blitt omgjort fra et skadelig middel til et mest nyttig (intra- og ekstracellulært) signalmolekyl. Oppfinnelse av intracellulær transport økte rollen for Ca(2+) homeostase ytterligere, som ble kritisk for regulering av celleoverlevelse og celledød. Flere gjensidig avhengige effekter av Ca(2+) og ATP har blitt utnyttet i evolusjonen, og har dermed gjort en opprinnelig vanhellig allianse til en fascinerende suksesshistorie.
ATP-effekter formidles av en utvidet familie av purinoseptorer ofte knyttet til Ca(2+)-signalering. I likhet med atmosfærisk oksygen, må Ca(2+) ha blitt omgjort fra et skadelig middel til et mest nyttig (intra- og ekstracellulært) signalmolekyl. Oppfinnelse av intracellulær transport økte rollen for Ca(2+) homeostase ytterligere, som ble kritisk for regulering av celleoverlevelse og celledød. Flere gjensidig avhengige effekter av Ca(2+) og ATP har blitt utnyttet i evolusjonen, og har dermed gjort en opprinnelig vanhellig allianse til en fascinerende suksesshistorie.
Reguleringen av en celles Ca 2+-signalverktøysett: Ca 2+-homeostasomet
Ca 2+-ionet fungerer som en allestedsnærværende annen-budbringer i eukaryote celler og endringer i den intracellulære Ca 2+-konsentrasjonen regulerer mange responser i en celle, men også kommunikasjon mellom celler. For å gjøre bruk av et slikt tilsynelatende enkelt signal, dvs. en endring i den intracellulære Ca 2+-konsentrasjonen, er cellene utstyrt med sofistikert maskineri for nøyaktig å regulere formen (amplitude, varighet) til Ca 2+-signaler på en lokaliseringsspesifikk måte . For å fastslå en så presis regulering, stoler celler på komponentene i Ca 2+ signalverktøysettet. Dette omfatter Ca 2+ inngangssystemer inkludert Ca 2+ kanaler i plasma-membranen og organell-membraner, og Ca 2+ ekstrudering/opptakssystemer, inkludert Ca 2+ -ATPaser (Ca 2+ pumper) og Na + /Ca 2+ vekslere. Ca 2+ -signalkomponentene orkestrerer sin aktivitet for å fastslå den høye nøyaktigheten av intracellulær Ca 2+ signalering. Summen av molekylene som bygger nettverket av Ca 2+-signalkomponenter, og som er involvert i sin egen regulering for å opprettholde fysiologisk Ca 2+-homeostase, som resulterer i fenotypisk stabilitet, kalles Ca 2+-homeostasomet.
 Ca2+ utløser liv ved befruktning og kontrollerer utvikling og differensiering av celler til spesialiserte typer. Det medierer den påfølgende aktiviteten til disse cellene og er til slutt alltid involvert i celledød. For å koordinere alle disse funksjonene, må Ca2+-signaler være fleksible, men presist regulert. Denne utrolige allsidigheten oppstår ved bruk av et Ca2+- signalerings "verktøysett", der ionet kan virke i de ulike kontekstene rom, tid og amplitude. Ulike celletyper velger deretter kombinasjoner av Ca2+-signaler med nøyaktige parametere, for å passe til deres fysiologi.
Ca2+ utløser liv ved befruktning og kontrollerer utvikling og differensiering av celler til spesialiserte typer. Det medierer den påfølgende aktiviteten til disse cellene og er til slutt alltid involvert i celledød. For å koordinere alle disse funksjonene, må Ca2+-signaler være fleksible, men presist regulert. Denne utrolige allsidigheten oppstår ved bruk av et Ca2+- signalerings "verktøysett", der ionet kan virke i de ulike kontekstene rom, tid og amplitude. Ulike celletyper velger deretter kombinasjoner av Ca2+-signaler med nøyaktige parametere, for å passe til deres fysiologi.
Konsentrasjonen av Ca2+ øker under forstyrrelse av stimuli, som blir gjenkjent av kalsiumbindende proteiner eller sensorproteiner. Disse proteinene overfører signalet videre nedstrøms for å starte fosforylerings-kaskade, som til slutt fører til regulering av genuttrykk
Modulasjonen i Ca2+-konsentrasjon over cellemembranen er i hovedsak mediert av tre klasser av transportører-
1. Ca2+-ATPaser (PMCA)
2. Ca2+ gjennomtrengelige kanaler, eller med andre ord: Ca2+ selektive kanaler
3. Ca2+/kation-antiportere (CaCA), eller med andre ord: Ca2+/H+ og Na+/Ca2+-vekslere
som kun fungerer i kombinasjon av hverandre.
Dette er et gjensidig avhengig system!
Bilde 6. Cellens livssyklus
Plasmamembranen kalsium ATPase
Plasmamembranen Ca2+ ATPase (PMCA) er et transportprotein i plasmamembranen til celler og fungerer for å fjerne kalsium (Ca2+) fra cellen ved å bruke energien som er lagret i ATP. Dermed er det nødvendig for cellene å bruke ionepumper for å fjerne Ca2+. PMCA ATPase-pumpen og natrium-kalsiumveksleren (NCX) er sammen de viktigste regulatorene for intracellulære Ca2+-konsentrasjoner. Den kanskje viktigste strukturelle egenskapen som skiller PMCA-pumpen fra alle andre medlemmer av superfamilien er tilstedeværelsen av en lang cytosolisk C-terminal hale, som har en essensiell rolle i reguleringen av aktiviteten til enzymet: det er stedet for interaksjon av regulatoriske partnere, sjef blant dem calmodulin, og er strukturen som er ansvarlig for mekanismen for auto-inhibering, som er en karakteristisk egenskap til PMCA-pumpen. Calmodulin samhandler med bindingsdomenet og fjerner det fra dokking-stedene ved siden av det aktive senteret, og frigjør pumpen fra auto-inhibering.
Spenningsavhengige kanaler ved plasmamembranen
Det antas at DACC-er bidrar til den korte forbigående tilstrømningen av Ca2+ som respons på ulike stimuli, inkludert avkjøling og mikrobeinteraksjon. Spenningsstyrte NaV-kanaler (NaVs) initierer aksjonspotensialer i eksitable celler og er avgjørende for elektrisk signalering fra bakterier til mennesker. Spenningsstyrte CaV-kanaler (CaVs) aktiveres ved depolarisering under aksjonspotensialer, og Ca2+-inngang gjennom dem initierer synaptisk overføring, muskelkontraksjon, hormonsekresjon og mange andre biokjemiske og fysiologiske prosesser. Disse kanalene antas å dele lignende spenningsavhengige aktiverings- og inaktiveringsprosesser, hvis strukturelle grunnlag er grunnleggende for elektrisk signalering. Hvordan disse kanalene raskt og selektivt kan lede Na+ eller Ca2+ ioner som svar på endringer i det elektriske membranpotensialet, er et avgjørende spørsmål i biologi.
Måtte ikke det riktige elektriske potensialet reguleres, programmeres og settes opp helt fra begynnelsen for å formidle funksjon for overlevelse til de første cellene?
Superfamilien Ca2+/Cation antiporter (CaCA).
Elektrokjemisk potensialdrevne Ca2+-transportører er for det meste Ca2+-transportsystemer med lav affinitet som bruker energien som er lagret i den  elektrokjemiske gradienten til ioner. Kationtransport er en kritisk prosess i alle organismer og er avgjørende for mineralernæring, ionestress-toleranse og signaloverføring.
elektrokjemiske gradienten til ioner. Kationtransport er en kritisk prosess i alle organismer og er avgjørende for mineralernæring, ionestress-toleranse og signaloverføring.
PMCA-ene er effektive til å opprettholde lav intern [Ca2+] over lang varighet, mens NCX og NCKX Ca2+/Cation-antiportere kan gjøre de raske justeringene som trengs under generering av aksjonspotensialer i nevroner.
Typer intracellulært Ca2+-signal
Når en Ca2+-kanal åpner seg, dannes en høykonsentrert 'fjærdusk' av Ca2+ rundt dens munn og forsvinner raskt ved diffusjon etter at kanalen har lukket seg. Slike lokaliserte signaler, som kan stamme fra kanaler i plasmamembranen eller på de interne lagrene, representerer de elementære hendelsene - de grunnleggende byggesteinene i Ca2+-signalering. De spatiotemporale egenskapene til disse elementære hendelsene, som Ca2+-gnister og Ca2+-puff, varierer, avhengig av arten og plasseringen av kanalene.
Ved å karakterisere disse signalene kan vi oppdage hvordan Ca2+- signalrepertoaret er utdypet. I hovedsak har disse elementære signalene to funksjoner. De kan enten aktivere svært lokaliserte cellulære prosesser i umiddelbar nærhet av kanalene (fig. 1a) eller, ved å rekruttere kanaler gjennom hele cellen, kan de aktivere prosesser på globalt nivå (fig. 1b, c). Den subcellulære plasseringen av Ca2+-kanaler er avgjørende for å målrette elementære signaler til forskjellige cellulære prosesser. I glatt muskulatur aktiverer for eksempel Ca2+-gnister som oppstår lokalt, nær plasmamembranen, kalium (K+)-kanaler (fig. 1a), og får muskelen til å slappe av. Men når elementære frigjøringshendelser dypere i cellen koordineres for å skape et globalt Ca2+-signal, trekker muskelen seg sammen.
Dette er et slående eksempel på hvordan romlig organisering gjør det mulig for Ca2+ å aktivere motsatte cellulære responser i samme celle.
Dette reiser spørsmålet hvordan den romlige organisasjonen oppsto. Prøving og feiling? Hadde ikke begge deler, plasseringen av kanalene som koordinerer de elementære frigjøringshendelsene dypere i cellen, og et globalt Ca2+-signal, som får muskelen til å trekke seg sammen, og plasseringen av kanalene som aktiverer signalene som aktiverer kalium, som forårsaker musklene å slappe av, å være på rett sted sammen, for å få begge nødvendige bevegelser samtidig ? En bevegelse uten den andre ville ikke gi mening. Det vil si at en muskel vil kunne trekke seg sammen, men ikke slappe av, og omvendt. Er ikke det et klart bevis på at hele mekanismen måtte settes opp helt fra begynnelsen, med hver kanal på rett sted?
Bilde 7. Selektive ione-kanaler styrer transporten
Tid
Et av paradoksene rundt Ca2+ er at det er et signal for både liv og død - selv om økninger i Ca2+ er nødvendig for at det skal fungere som et signal, kan langvarige økninger i konsentrasjonen av Ca2+ være dødelige. Celler unngår død enten ved å bruke Ca2+-signaler med lav amplitude eller, mer vanlig, ved å levere signalene som korte "transienter". Disse prinsippene gjelder både for elementære og globale signaler.
Det reiser et annet interessant spørsmål: Hvordan var koordineringsoppsettet første gang? prøving og feiling? Hvis forsøk ikke ville gi riktig konsentrasjon, men en langvarig, dør cellen. Døde cellen hver gang doseringen ikke var finjustert til lav amplitude? Er ikke det en klar indikasjon på at gradvis trinnvis evolusjonær utvikling av mekanismen ikke ville være mulig, men bare et alt eller ingenting-oppsett?
Enkelttransienter brukes til å aktivere visse cellulære prosesser, slik som sekresjon av cellulært materiale i membranbundne vesikler, eller muskelkontraksjon. Men når informasjon må videresendes over lengre tidsperioder, bruker cellene repeterende signaler kjent som Ca2+ oscillasjoner. Både de elementære hendelsene og de globale signalene kan svinge, men de har vidt forskjellige perioder. For eksempel, mens perioden med elementære Ca2+-gnister i arteriell glatt muskel er 0,1-0,5 sekunder, er den 10-60 sekunder for globale bølger i leverceller, 1-35 minutter for Ca2+-bølger i menneskelige egg etter befruktning, og 10-20 sekunder timer for de spontane Ca2+-transientene som kontrollerer celledeling.
Bilde 8. Signalering i celle-kommunikasjon
Varigheten av signalene måtte forhåndsprogrammeres, og følger reglene for informasjonsoverføring for koding, kodesending og dekoding, som kun kan settes opp av intelligens.
 Celler bruker frekvensmodulasjon (FM) for å variere intensiteten og naturen til den fysiologiske utgangen. For eksempel kan arterier fås til å utvide seg ved å øke frekvensen av Ca2+-gnister, som får den glatte muskelen langs arteriene til å slappe av. Og ved å variere frekvensen av globale Ca2+-signaler kan ulike gener aktiveres. For å bruke FM-signalering har celler dekodere som reagerer på frekvensen og levetiden til Ca2-signalene. Det mest kjente eksemplet er trolig et enzym kalt kalmodulin-avhengig proteinkinase II, som finnes i både dyre- og planteceller og som regulerer andre enzymer som er avhengige av Ca2+. Det fungerer ved å "telle" Ca2+ transienter og variere aktiviteten deretter.
Celler bruker frekvensmodulasjon (FM) for å variere intensiteten og naturen til den fysiologiske utgangen. For eksempel kan arterier fås til å utvide seg ved å øke frekvensen av Ca2+-gnister, som får den glatte muskelen langs arteriene til å slappe av. Og ved å variere frekvensen av globale Ca2+-signaler kan ulike gener aktiveres. For å bruke FM-signalering har celler dekodere som reagerer på frekvensen og levetiden til Ca2-signalene. Det mest kjente eksemplet er trolig et enzym kalt kalmodulin-avhengig proteinkinase II, som finnes i både dyre- og planteceller og som regulerer andre enzymer som er avhengige av Ca2+. Det fungerer ved å "telle" Ca2+ transienter og variere aktiviteten deretter.
Hvordan "lærte" den den bragden? Måtte ikke denne mekanismen være forhånds-programmert? Siden når kan tankeløs materie lære å telle og forstå informasjonssignaler?
Enzymet er satt sammen av mange identiske underenheter, og disse aktiveres i varierende grad avhengig av frekvensen av Ca2+-svingningene.
Amplitude
Informasjon kan også kodes i amplituden til Ca2+-signaler. Slik amplitudemodulert (AM) signalering anses generelt for å være mindre pålitelig enn den som er basert på frekvens, på grunn av vanskelighetene med å oppdage små Ca2+-endringer over bakgrunnsnivået. Det er imidlertid vist at celler kan tolke beskjedne endringer i konsentrasjonen av Ca2+. For eksempel kan forskjellige gener aktiveres ved å variere amplituden til Ca2+-signaler.
Bilde 9. Befruktning
 Befruktning og utvikling
Befruktning og utvikling
Hos pattedyr begynner livet ved befruktning når sædcellene samhandler med egget for å utløse en Ca2+-svingning som vedvarer i flere timer. Denne forlengede perioden med repeterende Ca2+-pulser utløser utviklingsprogrammet ved å stimulere det enzymatiske maskineriet involvert i celledelingssyklusen. Det er ingen ytterligere endringer i Ca2+ før encelleembryoet er klart til å dele seg når en spontan Ca2+ transient utløser spaltning for å danne to datterceller. Det er indikasjoner på at dette ryddige programmet kan kontrolleres av to distinkte oscillatorer - Ca2+ signaler og oscillerende nivåer av proteiner involvert i celledelingssyklusen. Ca2+ oscillatoren ser ut til å være hovedmekanismen fordi den vedvarer når den dissosieres fra cellesyklus-oscillatoren. Akkurat hva som driver denne Ca2+ oscillatoren, med en periode på 10-20 timer, er et mysterium, men det kan avhenge av periodiske økninger i nivået av en diffuserbar intracellulær budbringer kalt inositol 1,4,5-trisfosfat (Ins(1,4) ,5)P3) med hver divisjon. I mange celler aktiverer hormoner og vekstfaktorer enzymet fosfolipase C, som katalyserer produksjonen av InsP3 fra membranlipidet fosfatidylinositol 4,5-bisfosfat (boks 1).
Ettersom embryoer vokser og cellegrupper differensierer for å utføre spesialiserte funksjoner, bidrar Ca2+-signalering til kroppspolaritet og mønsterdannelse. Hos amfibier og sebrafisk antas det for eksempel å bidra til å spesifisere hvilke celler som vil danne strukturer på toppen (dorsal) eller nederste (ventrale) delen av embryoet. Når celler differensierer for å utføre forskjellige funksjoner, velger de ut de komponentene i Ca2+-signalverktøysettet som passer best for deres oppgave. Denne allsidigheten understrekes av økende bevis på at Ca2+ kontrollerer cellulære prosesser så forskjellige som celleproliferasjon og den nevronale plastisiteten som er ansvarlig for læring og hukommelse. Men når som helst kan enhver av disse ordnede signalhendelsene byttes for å aktivere et program som fører til celledød - en stor utfordring for fremtiden er å forstå hvordan Ca2+ plutselig forvandles fra et signal for liv til et signal om død.
Bilde 10. Celledød -apoptose

Dette er høyst relevant, da det viser at Ca2+-signalering er en del av verktøysettet for kroppsformdannelse, og hvis kroppsformen må endres, avhenger det også av endringen av Ca2+-signalering. En annen epigenetisk mekanisme som tilbakeviser makroevolusjon. Det er en stor utfordring hvis det foreslås naturalistiske opphav for fenomenet det gjelder, men når designet foreslås, er det fullt forklarlig at designeren forhåndsprogrammerte livssyklusen til cellene, det vil si cellesyklus, befruktning, celledifferensiering, spatiotemporal mønster , timing og amplitude av signalene, og regulering.
Celledød
Svært høye konsentrasjoner av Ca2+ kan føre til desintegrering av celler (nekrose) gjennom aktiviteten til Ca2+-sensitive proteinfordøyende enzymer. Kalsium har også vært involvert i det mer ryddige programmet for celledød kjent som apoptose. Apoptose er viktig under både normal utvikling (dannelse av vevsmønstre, for eksempel) og patologiske tilstander som AIDS, Alzheimers sykdom og kreft. Et protein som er mutert i kreftceller, kalt Bcl-2, forhindrer celledød som normalt vil begrense overlevelsen og spredningen av kreftceller. Bcl-2 medierer noe av dens antiapoptotiske virkning ved å modifisere måten organeller som endoplasmatisk retikulum og mitokondrier (hvor respirasjon forekommer) håndterer Ca 2+
Oversettelse ved Asbjørn E. Lund
 Hvordan intracellulær kalsiumsignalering, gradient og dens rolle som en universell intracellulær regulator peker på design
Hvordan intracellulær kalsiumsignalering, gradient og dens rolle som en universell intracellulær regulator peker på design Hvordan intracellulær kalsiumsignalering, gradient og dens rolle som en universell intracellulær regulator peker på design
Hvordan intracellulær kalsiumsignalering, gradient og dens rolle som en universell intracellulær regulator peker på design Cellenes evne til å opprettholde en stor gradient av kalsium over deres ytre membran er universell. Alle biologiske celler har lav cytosolisk (væske som finnes inne i celler) kalsiumkonsentrasjon, kan og må beholde denne selv når det frie kalsiumet utenfor er opptil 20 000 ganger høyere konsentrert! De første livsformene krevde et effektivt Ca2+ homeostatisk system, som opprettholdt intracellulær Ca2+ i behagelig lave konsentrasjoner - et sted rundt 100 nanomolar, dette er ~10 000-20 000 ganger lavere enn det i det ekstracellulære miljøet. Bekadigelse av plasmamembranens evne til å opprettholde denne gradienten, vil få kalsium til å strømme inn i cellen, utfelle kalsiumfosfat, skade det ATP-genererende maskineriet og drepe cellen. Ved millimolare konsentrasjoner konkurrerer kalsium med Mg2+ (magnesium), binder seg til DNA og RNA og hemmer det.
Cellenes evne til å opprettholde en stor gradient av kalsium over deres ytre membran er universell. Alle biologiske celler har lav cytosolisk (væske som finnes inne i celler) kalsiumkonsentrasjon, kan og må beholde denne selv når det frie kalsiumet utenfor er opptil 20 000 ganger høyere konsentrert! De første livsformene krevde et effektivt Ca2+ homeostatisk system, som opprettholdt intracellulær Ca2+ i behagelig lave konsentrasjoner - et sted rundt 100 nanomolar, dette er ~10 000-20 000 ganger lavere enn det i det ekstracellulære miljøet. Bekadigelse av plasmamembranens evne til å opprettholde denne gradienten, vil få kalsium til å strømme inn i cellen, utfelle kalsiumfosfat, skade det ATP-genererende maskineriet og drepe cellen. Ved millimolare konsentrasjoner konkurrerer kalsium med Mg2+ (magnesium), binder seg til DNA og RNA og hemmer det.  funksjonen involverer Ca2+ proteinbaserte og ikke-proteinholdige kanaler, Ca2+ antiportere (Ca2+/2H+, Ca2+/Na+) og ATP-avhengige Ca2+ pumper.
funksjonen involverer Ca2+ proteinbaserte og ikke-proteinholdige kanaler, Ca2+ antiportere (Ca2+/2H+, Ca2+/Na+) og ATP-avhengige Ca2+ pumper. Gitt den sentrale rollen til intracellulær kalsiumsignalering i den levende verden, er en bedre forståelse av sammensetningen av dette kalsiumsignalerings-verktøysettet, og proteinene som utgjør det, avgjørende for vår globale forståelse av hva som var nødvendig for at celler skulle dukke opp. Disse vitenskapelige studiene fremhever den høye bevaringen av kalsium-verktøysettet fra prokaryoter til metazoer og den økende kompleksiteten til proteinene som utgjør det. Nødvendigheten av å eksportere Ca2+ fra celler er en direkte konsekvens av Ca2+-signalets ambivalente natur. Ca2+ er viktig for cellene: Det styrer opprinnelsen til nytt liv ved befruktning og hjelper cellene når deres vitale syklus har kommet til slutten. Mellom opprinnelse og slutt veileder imidlertid Ca2+ cellene i det meste av det de må gjøre for å oppfylle oppgavene som er tildelt dem. Balansen av Ca2+ mellom celler og omgivelsene utenfor må reguleres med ytterste presisjon: enhver flukt som på en eller annen måte vil endre balansen ved å la intern Ca2+ øke over det optimale nivået, gir undergang for cellene.
Gitt den sentrale rollen til intracellulær kalsiumsignalering i den levende verden, er en bedre forståelse av sammensetningen av dette kalsiumsignalerings-verktøysettet, og proteinene som utgjør det, avgjørende for vår globale forståelse av hva som var nødvendig for at celler skulle dukke opp. Disse vitenskapelige studiene fremhever den høye bevaringen av kalsium-verktøysettet fra prokaryoter til metazoer og den økende kompleksiteten til proteinene som utgjør det. Nødvendigheten av å eksportere Ca2+ fra celler er en direkte konsekvens av Ca2+-signalets ambivalente natur. Ca2+ er viktig for cellene: Det styrer opprinnelsen til nytt liv ved befruktning og hjelper cellene når deres vitale syklus har kommet til slutten. Mellom opprinnelse og slutt veileder imidlertid Ca2+ cellene i det meste av det de må gjøre for å oppfylle oppgavene som er tildelt dem. Balansen av Ca2+ mellom celler og omgivelsene utenfor må reguleres med ytterste presisjon: enhver flukt som på en eller annen måte vil endre balansen ved å la intern Ca2+ øke over det optimale nivået, gir undergang for cellene. ATP-effekter formidles av en utvidet familie av purinoseptorer ofte knyttet til Ca(2+)-signalering. I likhet med atmosfærisk oksygen, må Ca(2+) ha blitt omgjort fra et skadelig middel til et mest nyttig (intra- og ekstracellulært) signalmolekyl. Oppfinnelse av intracellulær transport økte rollen for Ca(2+) homeostase ytterligere, som ble kritisk for regulering av celleoverlevelse og celledød. Flere gjensidig avhengige effekter av Ca(2+) og ATP har blitt utnyttet i evolusjonen, og har dermed gjort en opprinnelig vanhellig allianse til en fascinerende suksesshistorie.
ATP-effekter formidles av en utvidet familie av purinoseptorer ofte knyttet til Ca(2+)-signalering. I likhet med atmosfærisk oksygen, må Ca(2+) ha blitt omgjort fra et skadelig middel til et mest nyttig (intra- og ekstracellulært) signalmolekyl. Oppfinnelse av intracellulær transport økte rollen for Ca(2+) homeostase ytterligere, som ble kritisk for regulering av celleoverlevelse og celledød. Flere gjensidig avhengige effekter av Ca(2+) og ATP har blitt utnyttet i evolusjonen, og har dermed gjort en opprinnelig vanhellig allianse til en fascinerende suksesshistorie. Ca2+ utløser liv ved befruktning og kontrollerer utvikling og differensiering av celler til spesialiserte typer. Det medierer den påfølgende aktiviteten til disse cellene og er til slutt alltid involvert i celledød. For å koordinere alle disse funksjonene, må Ca2+-signaler være fleksible, men presist regulert. Denne utrolige allsidigheten oppstår ved bruk av et Ca2+- signalerings "verktøysett", der ionet kan virke i de ulike kontekstene rom, tid og amplitude. Ulike celletyper velger deretter kombinasjoner av Ca2+-signaler med nøyaktige parametere, for å passe til deres fysiologi.
Ca2+ utløser liv ved befruktning og kontrollerer utvikling og differensiering av celler til spesialiserte typer. Det medierer den påfølgende aktiviteten til disse cellene og er til slutt alltid involvert i celledød. For å koordinere alle disse funksjonene, må Ca2+-signaler være fleksible, men presist regulert. Denne utrolige allsidigheten oppstår ved bruk av et Ca2+- signalerings "verktøysett", der ionet kan virke i de ulike kontekstene rom, tid og amplitude. Ulike celletyper velger deretter kombinasjoner av Ca2+-signaler med nøyaktige parametere, for å passe til deres fysiologi. elektrokjemiske gradienten til ioner. Kationtransport er en kritisk prosess i alle organismer og er avgjørende for mineralernæring, ionestress-toleranse og signaloverføring.
elektrokjemiske gradienten til ioner. Kationtransport er en kritisk prosess i alle organismer og er avgjørende for mineralernæring, ionestress-toleranse og signaloverføring. Celler bruker frekvensmodulasjon (FM) for å variere intensiteten og naturen til den fysiologiske utgangen. For eksempel kan arterier fås til å utvide seg ved å øke frekvensen av Ca2+-gnister, som får den glatte muskelen langs arteriene til å slappe av. Og ved å variere frekvensen av globale Ca2+-signaler kan ulike gener aktiveres. For å bruke FM-signalering har celler dekodere som reagerer på frekvensen og levetiden til Ca2-signalene. Det mest kjente eksemplet er trolig et enzym kalt kalmodulin-avhengig proteinkinase II, som finnes i både dyre- og planteceller og som regulerer andre enzymer som er avhengige av Ca2+. Det fungerer ved å "telle" Ca2+ transienter og variere aktiviteten deretter.
Celler bruker frekvensmodulasjon (FM) for å variere intensiteten og naturen til den fysiologiske utgangen. For eksempel kan arterier fås til å utvide seg ved å øke frekvensen av Ca2+-gnister, som får den glatte muskelen langs arteriene til å slappe av. Og ved å variere frekvensen av globale Ca2+-signaler kan ulike gener aktiveres. For å bruke FM-signalering har celler dekodere som reagerer på frekvensen og levetiden til Ca2-signalene. Det mest kjente eksemplet er trolig et enzym kalt kalmodulin-avhengig proteinkinase II, som finnes i både dyre- og planteceller og som regulerer andre enzymer som er avhengige av Ca2+. Det fungerer ved å "telle" Ca2+ transienter og variere aktiviteten deretter. Befruktning og utvikling
Befruktning og utvikling